| |
|
|
| 本事業の実績 / 2011-2012 I 本事業の実績 / 2009-2010 I 過去の実績 |
|
|
|
|
|
1. 先端研究拠点事業の実施状況 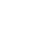   |
|
「国際戦略型」への以降に伴い国際会議を年に2回開催できるようになり、2011年度はまず8月にフィンランド・タンペレでのサマーセミナーを持ちました。(fig1)。
10月には名古屋で日本胸部外科学会と共催で国際ワークショップを開催しました。Haverich教授の基調講演に続いてロンドンの鈴木憲教授、女子医大の清水達也教授の特別講演と中身の濃い内容となりました。昼食を交えて3国コーディネーターによるトップ会談も行われ、事業の更なる発展を実感した1日でした(fig2)。 |
 2012年度は6月の日本再生医療学会で国際シンポジウム・セミナーを開催しました。澤先生が会長を務められたパシフィコ横浜での会合は本事業のハイライトと言えるもので、数ヶ月前から教室の皆様、学会事務局と入念な準備を行い、海外からHaverich教授、Harjula教授に加えて、ハノーファーのBreymann先生とZweigerdt研究員、ヘルシンキのPatila先生を招請し、国内から早稲田大学の岩崎清隆先生と、国立循環器病センターの中山泰秀先生を招きました。 学会1日目の国際シンポジウムでは澤教授の挨拶、Haverich教授の基調講演に続き、Tissue Engineered (TE) 弁の研究成果を日独間で発表し、 2012年度は6月の日本再生医療学会で国際シンポジウム・セミナーを開催しました。澤先生が会長を務められたパシフィコ横浜での会合は本事業のハイライトと言えるもので、数ヶ月前から教室の皆様、学会事務局と入念な準備を行い、海外からHaverich教授、Harjula教授に加えて、ハノーファーのBreymann先生とZweigerdt研究員、ヘルシンキのPatila先生を招請し、国内から早稲田大学の岩崎清隆先生と、国立循環器病センターの中山泰秀先生を招きました。 学会1日目の国際シンポジウムでは澤教授の挨拶、Haverich教授の基調講演に続き、Tissue Engineered (TE) 弁の研究成果を日独間で発表し、 最後はHarjula教授の細胞移植の臨床研究の発表と続き(左)、2日目の国際セミナーは日独芬の若手研究者が集い、心筋組織再生研究の最新の研究成果を交換しました。これには京都大学iPS細胞研究所(CiRA)の吉田善紀先生をコメンテーターとして招き、更には同時開催された国際幹細胞学会(ISSCR)に参加中のハノーファー医大LEBAO研究所のMartin所長、Gruh研究員も参加されました。 夜の会長招宴では招請者全員に、女子医大の岡野教授やドイツ・マックスプランク研究所のSchaper教授夫妻、俳優の辰巳琢郎さんらを交えた交流が行われました(右)。 最後はHarjula教授の細胞移植の臨床研究の発表と続き(左)、2日目の国際セミナーは日独芬の若手研究者が集い、心筋組織再生研究の最新の研究成果を交換しました。これには京都大学iPS細胞研究所(CiRA)の吉田善紀先生をコメンテーターとして招き、更には同時開催された国際幹細胞学会(ISSCR)に参加中のハノーファー医大LEBAO研究所のMartin所長、Gruh研究員も参加されました。 夜の会長招宴では招請者全員に、女子医大の岡野教授やドイツ・マックスプランク研究所のSchaper教授夫妻、俳優の辰巳琢郎さんらを交えた交流が行われました(右)。
 8月にはハノーファーでサマーセミナーを行いました。澤教授はじめ阪大から10名、留学中の今西・斎藤両先生にヘルシンキ、ハノーファーの参加者を加えると総勢30名を超える規模になりました。初日はHaverich教授の歓迎の挨拶に始まり、心筋再生の臨床研究の発表、LEBAO研究所訪問の後、市内観光、そして郊外のマリエンブルグ城を訪れ、そこでの野外夕食会となりました。 2日目はHaverich教授の計らいでセミナー前に澤教授らが臨床カンファ・ICU回診に招待され、午前の特別セッションではTE弁に関するハノーファーの10年余にわたるTE弁の研究の歴史や臨床研究の成果、そして昨年から始まっている欧州での多施設臨床試験の概要が発表され、澤教授との間で熱心な議論が交わされました。午後は若手の研究発表で、鎌田先生、甲斐沼先生、今西先生が最新の研究成果を発表してくれました。セミナーの合間にとった集合写真は(左)当時Rebirthのホームページのトップに掲載され、Haverich教授の本事業に対する理解と期待も大きくなってきていることを感じる大変意義ある会合でした。 8月にはハノーファーでサマーセミナーを行いました。澤教授はじめ阪大から10名、留学中の今西・斎藤両先生にヘルシンキ、ハノーファーの参加者を加えると総勢30名を超える規模になりました。初日はHaverich教授の歓迎の挨拶に始まり、心筋再生の臨床研究の発表、LEBAO研究所訪問の後、市内観光、そして郊外のマリエンブルグ城を訪れ、そこでの野外夕食会となりました。 2日目はHaverich教授の計らいでセミナー前に澤教授らが臨床カンファ・ICU回診に招待され、午前の特別セッションではTE弁に関するハノーファーの10年余にわたるTE弁の研究の歴史や臨床研究の成果、そして昨年から始まっている欧州での多施設臨床試験の概要が発表され、澤教授との間で熱心な議論が交わされました。午後は若手の研究発表で、鎌田先生、甲斐沼先生、今西先生が最新の研究成果を発表してくれました。セミナーの合間にとった集合写真は(左)当時Rebirthのホームページのトップに掲載され、Haverich教授の本事業に対する理解と期待も大きくなってきていることを感じる大変意義ある会合でした。
若手研究者の交流に関しては、ヘルシンキに白川先生が2011年9月から2012年2月まで、引き続いて今西先生が2012年10月まで滞在しました。ハノーファーには斎藤哲也先生が2011年8月からが3ヶ月滞在した後、2012年4月から斎藤俊輔先生が留学して実験に励んでくれています。また、阪大にはヘルシンキからポスドクのAntti Siltanen君が2012年4月から留学してiPS細胞を用いた共同研究を行い、更に充実した交流が実現されてきています。
【本事業の今後と国際臨床研究】
先端研究拠点事業も4年目を迎え、持続的な発展が続いています。留学に関しては教室からヘルシンキあるいはハノーファーへの留学者は、長期・短期を含めて14名に達し、シンポジウム・ワークショップ・セミナー等の会議に関してもウィーン、ジュネーブ、タンペレ、名古屋、横浜、ハノーファーの6回に至りました。2013年度は4月の神戸で開催されるアジア心臓血管外科学会時に関西で国際シンポジウム・セミナーを計画しており、8月にはサマーセミナーをヘルシンキで開催する予定にしています。交流ネットワークも広がり、参加者も増加の一途を辿っています。今後も若手諸君の積極的な参加を期待しています。 本事業は2013年度で終了ですので、発展しつつあるこの国際コンソーシウムを今後どのように維持・発展させていくか事業資金を含めて検討する時期に来ています。事業成果をまとめる時期でもあり、教室の研究業績・臨床業績としてまとめる必要も感じています。また、国際共同研究の過程で懸案となっている、心筋シートおよびTE弁の国際臨床研究をどのように実現していくかも大きな課題です。今後心筋・心臓弁の再生研究は、iPS細胞や新たな培養方法を用いた手法で国際的に益々発展していくことに疑いの余地はありませんが、国際臨床研究には基礎分野での共同研究に比べて様々なハードルがあり、これを今後どう克服していくかが楽しみです。
ハノーファー医科大学 小野 正道 |

 |
| fig1 |
 |
| fig2 |
| |
| |
| |
| |
| |
|
|
 |
|
 |
 3. ヘルシンキ大学の実績 3. ヘルシンキ大学の実績 |
|
心筋梗塞に対する他家筋芽細胞と
間葉系幹細胞混和シート移植療法の開発
:今西悠基子, Esko Kankuri, Ari Harjula
背景
これまで臨床研究において虚血性心疾患に対する自己由来筋芽細胞シート移植療法の有効性および安全性が示されてきた。しかしながら緊急時対応や移植用細胞の均質性保証等といった課題が残されており、これらを克服するために自己細胞に替わり他家細胞の検討が必要である。他家筋芽細胞移植の場合は免疫応答の制御が必要である。近年、間葉系幹細胞(MSC)は免疫応答を抑制する生理活性物質を分泌すること、その免疫抑制能はiNOSの発現により増強されることが報告されている。本研究では心筋梗塞に対する細胞移植においてアロ筋芽細胞移植にMSCを併用することにより免疫応答を緩和し、治療効果を示すと考え検討を行った。
方法および目的
MSCにおけるiNOS発現を増強させるため培養中のMSCに炎症性サイトカインを添加したところ、インターフェロンγ(IFNγ)およびリポ多糖(LPS)で刺激した場合に発現上昇を認めた。
図1.MSCにおけるiNOS発現のウェスタンブロット解析。
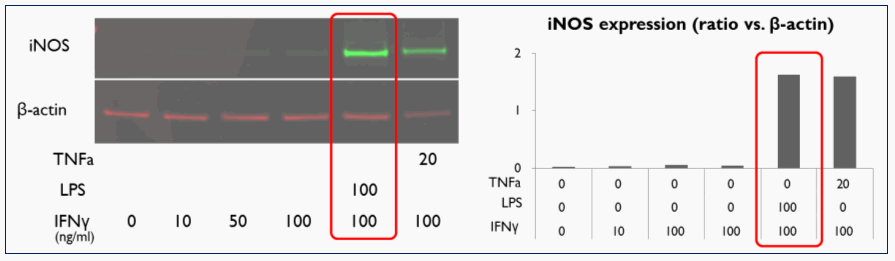
次に、ルシフェラーゼ遺伝子を導入した他家筋芽細胞で細胞シートを作製し、皮下における他家筋芽細胞の生着を生体内イメージングシステムで評価した。他家筋芽細胞単独では10日後に他家筋芽細胞が検出されないのに対し、他家筋芽細胞にMSCを混和したシートでは10日後にも強いシグナルが検出された。12日後iNOS増強MSCを混和したシートの場合のみシグナルが検出された。
図2.ルシフェラーゼ遺伝子導入他家筋芽細胞シート皮下移植。
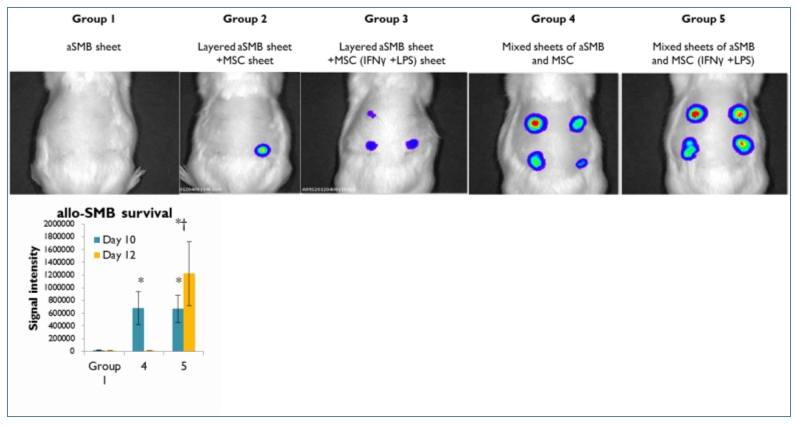
今後、ラット心筋梗塞モデルを用いて他家筋芽細胞・MSCの混和シートの免疫抑制効果、他家筋芽細胞の生着、および治療効果について検討が必要である。
図3.心筋梗塞モデルラットに対する細胞混和シート移植プロトコール
結論
他家筋芽細胞シートにiNOS発現を増強したMSCを混和することにより、他家筋芽細胞の生着期間の延長を認めた。心不全に対する他家筋芽細胞シート移植において、MSC併用移植は免疫抑制剤を使わないで移植細胞の生着期間を延長する方法として有用である可能性が示唆された。
|
|
|
 |
 4. 大阪大学の実績 / 大阪大学心臓血管外科 4. 大阪大学の実績 / 大阪大学心臓血管外科 |
|
大阪大学心臓血管外科の主な研究テーマ
大阪大学心臓血管外科領域の主な研究テーマは、これまで行われてきた極めて侵襲の高い外科的治療法をいかにして、侵襲の少ない、患者の体に優しい治療法を開発するかを基本的なコンセプトとして研究を進めている。
重症心不全に対する再生型治療の開発
現在、大阪大学では、拡張型心筋症、虚血性心筋症患者に対する筋芽細胞シート移植の臨床研究を行っている。人工心臓を装着した拡張型心筋症患者4例に筋芽細胞シートを移植し、3例において、心機能が向上し、2例が人工心臓より離脱した。また、人工心臓を装着していない虚血性心筋症、拡張型心筋症患者13例に自己筋芽細胞シートを移植した。これらの患者の一部において、左室容積の縮小化、血流の回復等のreverse remodeling効果を認めた。現在では企業による治験を開始している。また筋芽細胞シートをベースとした新規薬剤の開発も行っており、同薬剤の臨床応用を目指している。 筋芽細胞は、心臓への移植後、心筋細胞へは分化せず、Connexin43も発現しないため、レシピエント心筋とは協働して収縮しない。従って、その心機能回復効果は、シートから発現する肝細胞増殖因子等によるパラクライン効果であると考えられ、臨床例でも線維化の進んだ、残存心筋が少ない心不全に対しては、効果が薄いことが検証されており、このような心筋に対してはレシピエント心と電気的に結合し、直接心臓に収縮力を与えるような、心筋細胞と同様の電気的活動性を有する心筋細胞様の細胞を補充することが必要と考える。 この問題点を解決するためには、iPS細胞から心筋細胞に分化誘導し、細胞を大量に培養し、温度応答性培養皿を用いて細胞シートを作成し、不全心に移植するような再生型治療の臨床応用を目指すことであると思われる(図1)。現在、大動物心不全モデルを用いた非臨床試験は完了しており、iPS細胞由来心筋細胞シートの安全性の検討段階にはいっている。
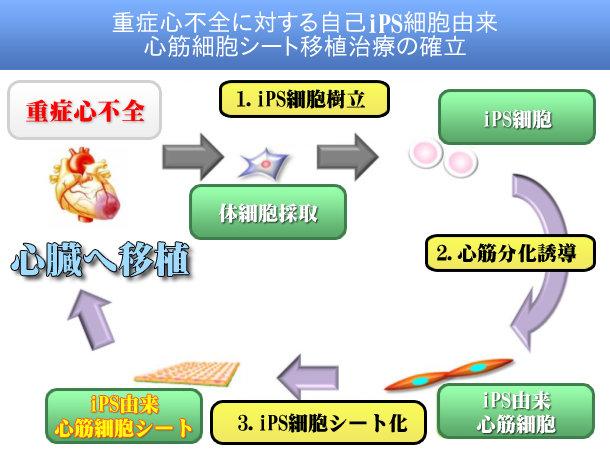
 図1 図1
動脈瘤に対する再生型治療とステントを混合したハイブリット治療の開発
また、これまでの大動脈瘤治療は、動脈瘤を人工血管に置換する手術を主体とした治療であるが、より低侵襲に大動脈瘤内のステントを留置し、これを治癒させる、患者にとって極めて低侵襲な方法が臨床の場で行われている。さらに、大動脈ステントの効果を高めるために、大動脈ステントに細胞遊走を促すような薬剤をコンジュゲートし、大動脈ステントを自己大動脈と一体化させるような新規ステントの開発も行っている(図2)。
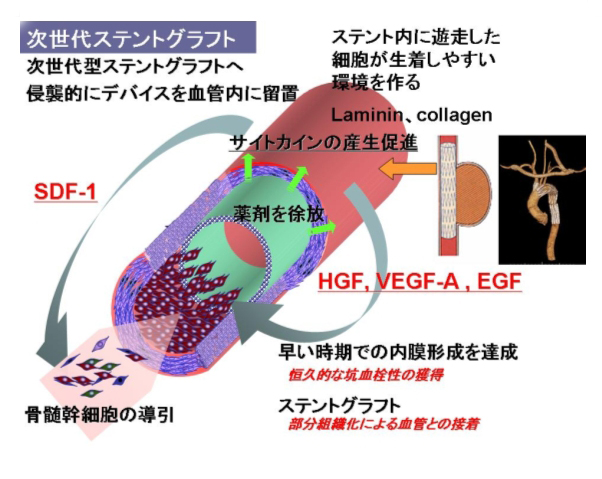
 図2 図2
| 1. |
| In Vivo Differentiation of Induced Pluripotent Stem Cell-Derived Cardiomyocytes. |
| Yu T, Miyagawa S, Miki K, Saito A, Fukushima S, Higuchi T, Kawamura M, Kawamura T, Ito E, Kawaguchi N, Sawa Y, Matsuura N. |
| Circ J. 2013 Feb 8. |
|
| 2. |
| Tissue- and Plasma-Specific MicroRNA Signatures for Atherosclerotic Abdominal Aortic Aneurysm. |
| Kin K, Miyagawa S, Fukushima S, Shirakawa Y, Torikai K, Shimamura K, Daimon T, Kawahara Y, Kuratani T, Sawa Y. |
| J Am Heart Assoc. 2012 Oct;1(5):e000745. |
|
| 3. |
| Myocardial Layer-Specific Effect of Myoblast Cell-Sheet Implantation Evaluated by Tissue Strain Imaging. |
| Shudo Y, Miyagawa S, Nakatani S, Fukushima S, Sakaguchi T, Saito A, Asanuma T, Kawaguchi N, Matsuura N, Shimizu T, Okano T, Sawa Y. |
| Circ J. 2012 Dec 29. |
|
| 4. |
| Bioengineered myocardium derived from induced pluripotent stem cells improves cardiac function and attenuates cardiac remodeling following chronic myocardial infarction in rats. |
| Miki K, Uenaka H, Saito A, Miyagawa S, Sakaguchi T, Higuchi T, Shimizu T, Okano T, Yamanaka S, Sawa Y. |
| Stem Cells Transl Med. 2012 May;1(5):430-7. |
|
| 5. |
| Feasibility, safety, and therapeutic efficacy of human induced pluripotent stem cell-derived cardiomyocyte sheets in a porcine ischemic cardiomyopathy model. |
| Kawamura M, Miyagawa S, Miki K, Saito A, Fukushima S, Higuchi T, Kawamura T, Kuratani T, Daimon T, Shimizu T, Okano T, Sawa Y. |
| Circulation. 2012 Sep 11;126(11 Suppl 1):S29-37. |
|
| 6. |
| Intracoronary artery transplantation of cardiomyoblast-like cells from human adipose tissue-derived multi-lineage progenitor cells improve left ventricular dysfunction and survival in a swine model of chronic myocardial infarction. |
| Okura H, Saga A, Soeda M, Miyagawa S, Sawa Y, Daimon T, Ichinose A, Matsuyama A. |
| Biochem Biophys Res Commun. 2012 Sep 7;425(4):859-65. doi: 10.1016/j.bbrc.2012.08.004. Epub 2012 Aug |
|
| 7. |
| Transplantation of elastin-secreting myoblast sheets improves cardiac function in infarcted rat heart. |
| Uchinaka A, Kawaguchi N, Hamada Y, Miyagawa S, Saito A, Mori S, Sawa Y, Matsuura N. |
| Mol Cell Biochem. 2012 Sep;368(1-2):203-14. doi: 10.1007/s11010-012-1361-4. Epub 2012 Jun 21. |
|
| 8. |
| Myoblast sheet can prevent the impairment of cardiac diastolic function and late remodeling after left ventricular restoration in ischemic cardiomyopathy. |
| Saito S, Miyagawa S, Sakaguchi T, Imanishi Y, Iseoka H, Nishi H, Yoshikawa Y, Fukushima S, Saito A, Shimizu T, Okano T, Sawa Y. |
| Transplantation. 2012 Jun 15;93(11):1108-15. |
|
| 9. |
| Tissue engineered myoblast sheets improved cardiac function sufficiently to discontinue LVAS in a patient with DCM: report of a case. |
| Sawa Y, Miyagawa S, Sakaguchi T, Fujita T, Matsuyama A, Saito A, Shimizu T, Okano T. |
| Surg Today. 2012 Jan;42(2):181-4. doi: 10.1007/s00595-011-0106-4. Epub 2011 Dec 27. |
|
| 10. |
| Establishing new porcine ischemic cardiomyopathy model by transcatheter ischemia-reperfusion of the entire left coronary artery system for preclinical experimental studies. |
| Shudo Y, Miyagawa S, Fukushima S, Saito A, Kawaguchi N, Matsuura N, Sawa Y. |
| Transplantation. 2011 Oct 15;92(7):e34-5. |
|
| 11. |
| Induced adipocyte cell-sheet ameliorates cardiac dysfunction in a mouse myocardial infarction model: a novel drug delivery system for heart failure. |
| Imanishi Y, Miyagawa S, Maeda N, Fukushima S, Kitagawa-Sakakida S, Daimon T, Hirata A, Shimizu T, Okano T, Shimomura I, Sawa Y |
| Circulation. 2011 Sep 13;124(11 Suppl):S10-7. |
|
| 12. |
| Novel regenerative therapy using cell-sheet covered with omentum flap delivers a huge number of cells in a porcine myocardial infarction model. |
| Shudo Y, Miyagawa S, Fukushima S, Saito A, Shimizu T, Okano T, Sawa Y. |
| J Thorac Cardiovasc Surg. 2011 Nov;142(5):1188-96. doi: 10.1016/j.jtcvs.2011.07.002. Epub 2011 Sep 14. |
|
| 13. |
| Clinical impact of combined transplantation of autologous skeletal myoblasts and bone marrow mononuclear cells in patients with severely deteriorated ischemic cardiomyopathy. |
| Fujita T, Sakaguchi T, Miyagawa S, Saito A, Sekiya N, Izutani H, Sawa Y. |
| Surg Today. 2011 Aug;41(8):1029-36. doi: 10.1007/s00595-010-4526-3. Epub 2011 |
|
| 14. |
| Allogenic skeletal myoblast transplantation in acute myocardial infarction model rats. |
| Imanishi Y, Miyagawa S, Saito A, Kitagawa-Sakakida S, Sawa Y. |
| Transplantation. 2011 Feb 27;91(4):425-31. |
|
| 15. |
| Tissue-engineered cardiac constructs for cardiac repair. |
| Miyagawa S, Roth M, Saito A, Sawa Y, Kostin S. |
| Ann Thorac Surg. 2011 Jan;91(1):320-9. doi: 10.1016/j.athoracsur.2010.09.080. Review. |
|
| |
|
|
|
|
| |
| |
 |
|
|
|
|